世界主要國家生物醫藥創去九宮格見證新系統的案例研究_中國網
中國網/中國發展門戶網訊 生物醫藥產業是全球競爭性產業,各國發展的基礎、時間、體制機制不同,取得的成效不同,也面臨不同的難題。“盡量多的盲人一起摸才能更客觀地還原大象原本的樣子”。各國通過自身實踐,累積的成功經驗和失敗教訓,對我國政策制定者把握關鍵問題、制定相關政策,進而推動生物醫藥產業高質量發展,具有重要的參考價值。
案例研究
“英國研究+美國專利+美國商業化+英國諾獎”
英國研究:1928年,亞歷山大·弗萊明(Alexander Fleming)在英國圣瑪麗醫院疫苗研究實驗室偶然發現青霉素,并于1929年在《英國實驗病理學期刊》(The British Journal of Experimental Pathology)上發表了相關發現,簡略談及了青霉素的潛在治療效果。在這個階段,青霉素的真正價值并未顯現。1937年,英國牛津大學的霍華德·弗洛里(Howard Florey)、恩斯特·錢恩(Ernst Chain)和諾曼·希特利(Norman Heatley)團隊研究溶菌酶時,注意到弗萊明的這篇論文,并得到一份他留下的青霉素樣品,從而進行了青霉素的提純和進一步研究工作。1940年,弗洛里團隊在《柳葉刀》(The Lancet)發表文章,描述了青霉素在小鼠實驗中對葡萄球菌、鏈球菌和梭菌等病原體引起的感染的療效。純化青霉素后,錢恩主張申請專利,而弗洛里傾向于放棄專利,造福世界。英國醫學研究委員會(MRC)因資金缺乏等原因,也反對申請專利。
美國專利+美國商業化:受二戰影響,英國沒有條件繼續資助青霉素的研發工作。1941年7月,弗洛里團隊在美國洛克菲勒基金會的資助下,到美國進行青霉素的開發工作。美國政府意識到青霉素的重要性,不僅提供市場、研究資金,還協調各部門的工作,調動了30多個實驗室、1000多位科學家,以及20多家制藥和化學公司來完成青霉素的產業化。由此,青霉素的開發權和生產技術的知識產權逐漸被美國控制。
英國諾獎:弗洛里、弗萊明和錢恩被授予1945年諾貝爾生理學或醫學獎。
美國政府為滿足軍方需求而開展的一場青霉素的產業化運動,為美國醫藥企業快速跨越式發展提供了絕佳路徑。由此,美國企業獲得了可觀盈利,積累了投資創新的資金,鍛煉了人才,夯實了產業基礎。而英國因二戰及“重學術輕專利”的學術文化的影響,陷入“諾獎歸我,專利歸他”的境地。英國的“種子”在美國結果,英國連基本的專利授權費也沒有得到,更不用說豐厚的產業化收入。
“中國研究+中國諾獎+歐美專利+歐美商業化”
中國研究:1967年5月,當時的國家科技委員會與解放軍原總后勤部組織召開會議,號召遍布全國的多家研究單位,仿造西藥或制造衍生物、從中藥中尋找抗瘧藥、制造驅蚊劑。屠呦呦研究小組通過查閱古方尋找可能的抗瘧新藥,從多種可能的動物藥、礦物藥和植物藥中進行篩選,最后鎖定了青蒿,但遇到了提取有效成分的難題。屠呦呦提出用乙醚提取青蒿,其提取物抗瘧作用達95%—100%,這一方法是當時發現青蒿粗提物有效性的關鍵。屠呦呦研究小組于1972年3月報告了這一結果。1977年,青蒿素的化學結構以“青蒿素結構研究協作小組”之名在《科學通報》上首次發表;1982年發表了英文論文。
中國錯失專利:20世紀70年代,中國還沒有建立專利制度。因此,雖于1972年提取出了青蒿素單體,但并未實施專利保護。同時,在青蒿素研發接近成果期時,中國研究人員在國內外發表了一系列文章;而專利授權的基本前提是“新的”,論文公開之后,如果超過6個月還沒申請專利,專利就會因為公開在先無法授權。因此,中國錯失了青蒿素類衍生物在國際上申請專利的最好時機。此后,中國開始研究起草專利法,1985年4月1日《中華人民共和國專利法》正式實施。軍事醫學科學院研發的復方蒿甲醚成為我國第一個嚴格按照國際標準開發、擁有自主知識產權的青蒿素類復方藥物。
歐美奪取專利:公開發表的文章導致技術細節暴露,國外在青蒿的引種栽培、育種和種植試驗、藥理研究,以及衍生物的研究均已全面啟動。美國軍方在美國本土也尋找到青蒿并提取出青蒿素,肯定青蒿素功效的文章于1985年在《科學》(Science)上發表。國外企業在青蒿素上逐漸構筑了厚實的專利“護城河”。
歐美商業化:瘧疾是全球性疾病,青蒿素進入國際市場需要符合一些規則和規范等監管要求。而中國改革開放初期,科學家及科研管理人員對藥品注冊、專利申請、臨床試驗和藥品生產的國際規范還比較陌生,軍事醫學科學院最后選擇與瑞士諾華公司合作。1991—2018年近30年的協議期中,中方獲得復方蒿甲醚的專利費收入接近2000萬美元。對于該項合作,諾華公司有著完整的專利戰略思路:先圍繞青蒿素衍生技術申請自有專利,再通過合作中的一些契機從中方手中購得某些關鍵專利,逐步從一個專利的被許可者變成專利壁壘的持有者,而中國藥企則淪為原料藥供應商。
中國諾獎:屠呦呦獲得2015年諾貝爾生理學或醫學獎。
由于中國的知識產權、監管政策、產業短板,同樣陷入“諾獎歸我,專利歸他”的境地,中國沒能像美國利用“青霉素”的產業化實現產業躍升。
“英國研究+英國諾獎+美國專利”
英國研究:1975年1月,英國研究員塞薩爾·米爾斯坦(César Milstein)和德國研究員喬治·科勒(George Köhler)在英國醫學研究委員會,研發出生產單克隆抗體的技術——雜交瘤技術。
英國錯失專利:負責為英國醫學研究委員會申請專利的國家研究與發展公司(NRDC)認為,雖然雜交瘤技術可能具有醫療和商業價值,但無法確定“任何立即的應用”,因此沒有迅速采取申請專利的行動。1976年8月,相關論文發表在《自然》(Nature)后,就錯失了在英國獲得該技術專利的機會——英國《專利法》規定,一旦論文公開發表就無法再申請專利保護。
美國專利:1979年10月和1980年4月,美國威斯塔研究所(Wistar)的希拉里·科普羅斯基(Hilary Koprowski)、卡洛·克羅斯(Carlo Croce)和沃爾特·格哈德(Walter Gerhard)接連獲得2項制造抗腫瘤和抗流感病毒的單克隆抗體的專利,開創了為制造單克隆抗體授予專利的先河。而這3位美國科學家使用的關鍵材料X63骨髓瘤細胞系,是由英國科學家米爾斯坦于1976年9月提供的。由于英國主要關注科學方面,沒有特別考慮商業應用;而且,當時由英國政府資助的科學家無權獲得專利特許權使用費。這進一步加劇了“重學術輕專利”的情況,導致英國錯失專利,反而間接幫助美國人拿到相關專利,這在英國引發了重大政治爭議。后來,英國對專利申請制度進行了重大改革。
英國諾獎:米爾斯坦和科勒獲得1984年諾貝爾生理學或醫學獎。
現在來看,米爾斯坦和科勒的單克隆抗體是從小鼠細胞中開發出來的,而這種單克隆抗體直接用于人體會產生免疫排斥反應。因此,即便美國科學家申請到專利,最后也無法成功商業化應用;但是,這種申請專利保護的意識和文化是“萬里長征第一步”,十分重要。
“英國研究+英國專利+英國諾獎+美國商業化”
英國研究:1986年,同樣在英國醫學研究委員會工作的格雷格·溫特(Greg Winter)開發出通過蛋白質工程實現單克隆抗體“人源化”的方法。
英國專利:英國醫學研究委員會這次迅速提交了該技術的專利申請,隨后多年在全球范圍內頒發了40多項非獨家許可。自那時起,英國醫學研究委員會從該項專利技術中獲得了近6億英鎊的特許權使用費收入。
英國、德國初期商業化:1989年,溫特成立了劍橋抗體技術公司(Cambridge Antibody Technology),其是早期涉足抗體工程的商業生物技術公司之一。1993年,劍橋抗體技術公司和德國巴斯夫公司(BASF)合作。通過平臺技術篩選,篩選到針對腫瘤壞死因子(TNF)抗原的人源化單克隆抗體,將其命名為D2E7。巴斯夫公司旗下醫藥公司Koll藥業,負責D2E7的臨床前和臨床研發工作。但Koll不擅長全球的創新藥學術推廣,而未來的開發與銷售還需投入更多且不確定性大,特別需要強有力的合作伙伴,因此將其出售。
美國最終成功商業化:美國雅培藥業用69億美元收購了Koll藥業,重點投入D2E7臨床后期的開發,最終開發出單克隆抗體藥——阿達木單抗(商品名:修美樂/Humira)。2002年獲得美國食品藥品監督管理局(FDA)批準用于類風濕關節炎患者;隨后幾年,修美樂獲批17種適應證,并在全球幾十個國家銷售,到2023年初已經獲得2128億美元的銷售收入。美國雅培藥業憑借69億美元的收購,加上后續臨床研發、適應證拓展、市場營銷、生產基地及物流的投入,換來超過2000億美元的回報。
英國諾獎:溫特獲得2018年諾貝爾化學獎。
英國吸取之前錯失專利的教訓,及時申請到了專利,隨后也進行了商業化的嘗試。最后成功的商業化在美國實現。英國獲得了一定的專利授權費用,但沒有收獲商業化的豐厚利潤。
“日本研究+日本專利+日本諾獎+美國商業化”
日本研究:20世紀90年代,日本是世界免疫學的研究重鎮,京都大學本庶佑課題組發現了PD-1單抗治療癌癥的可能性及相關機制,并于2002年在動物實驗中獲得了證實。
日本專利:2002年,本庶佑希望將此項研究轉化為治療患者的新藥,但是京都大學不具備任何管理能力或申請專利的知識,甚至沒有錢支付專利申請費用,無法為他提供幫助。他只能利用自己在業界的人脈,與日本小野制藥公司合作,申請到PD-1免疫療法的臨時專利。
美國商業化:日本公司對此療法表示懷疑,因為當時利用免疫療法治療癌癥的臨床試驗,都以失敗告終。本庶佑只能將希望轉向海外。總部位于美國普林斯頓的Medarex公司擁有業內先進的全人源抗體開發平臺,正在尋找富有潛力的研發項目;于2005年和小野制藥公司達成合作,共同推進這款免疫療法的臨床開發。2009年,百時美施貴寶(BMS)公司收購梅達雷克斯,將此療法命名為BMS-936558(后被稱為納武單抗/nivolumab),這使得研發過程得到質的飛躍。2014年7月,該款新藥在日本率先獲批上市,納武單抗(商品名:歐狄沃/Opdivo)成為全球首個獲得監管機構批準的PD-1抑制劑。Medarex和小野制藥已于2006年申請了《專利合作條約》(PCT)專利,后因并購協議,專利所有權為百時美施貴寶所持有。2017年,小野制藥和百時美施貴寶起訴默沙東公司侵犯專利,默沙東公司同意賠付6.25億美元的專利使用費,以及派姆單抗(Pembrolizumab)(商品名:可瑞達/Keytruda)2017—2022年銷售收入的6.5%,以及2023—2026年銷售收入的2.5%。
日本諾獎:本庶佑獲得2018年諾貝爾生理學或醫學獎。
從該案例可以看出,由于日本缺乏完善的專利轉化環境和商業化環境,日本基礎研究的成果也需要在美國才能轉化成臨床所需的藥品。日本得益于專利保護,可以獲得專利授權和專利侵權的賠付收入,但卻無法獲得商業化全部收入。
“美國研究+美國專利+美國商業化+美國諾獎”
美國研究+美國專利:20世紀90年代和21世紀初,美國賓夕法尼亞大學(以下簡稱“賓大”)的生物化學家卡塔林·卡里科(Katalin Karikó)和免疫學家德魯·魏斯曼(Drew Weissman)致力于把使用mRNA變成一項可行的技術,進行了艱苦的研究。當時,一些研究人員已經可以將mRNA有效地傳遞到體內,但無法使其在人體中安全地發揮作用。一開始的研究不太順利,1995年,卡里科在賓大被降職,資助也屢遭拒絕,甚至不得不在黑市上賣掉她的汽車來維持生計。轉折點出現在21世紀初,他們發現,將mRNA的尿苷(U)替換為假尿苷(ψ)可以順利逃逸細胞的免疫監測,達到在人體安全發揮作用的要求。這是開發mRNA疫苗的關鍵技術之一。兩人于2005年發表了文章并申請了相關專利。
美國商業化:2006年,卡里科和魏斯曼創立了RNARx公司,并于2007年和2009年得到美國國立衛生研究院(NIH)的小型企業技術轉讓計劃(STTR)的2筆共計近90萬美元的資助。賓大于2010年將專利獨家授予了美國一家實驗試劑供應公司Cellscript,獲得30萬美元專利授權費。后來,美國莫德納公司(Moderna)和德國拜恩泰科公司(BioNTech)開發的新冠mRNA疫苗都需要這項關鍵技術,因此向Cellscript支付了數億美元的轉授許可費。德國拜恩泰科公司和美國輝瑞共同開展研發活動,在拜恩泰科公司完成首次人體臨床研究后,輝瑞公司全權負責基于mRNA的新冠疫苗的進一步臨床開發和商業化。莫德納公司和拜恩泰科公司作為最先推出新冠mRNA疫苗的公司,僅2021年,這2個公司生產的新冠mRNA疫苗全球銷量就達到500億美元。
美國諾獎:卡里科和魏斯曼共同獲得2023年諾貝爾生理學或醫學獎。
此案例可以反映出美國生物醫藥創新系統從基礎研究到商業化轉化的概貌,涉及基礎研究、應用轉化、專利轉化、商業化等全過程。大學主動幫助申請專利,并能夠從中獲利;產業鏈上的企業也熱衷于向大學購買專利。作為一種投資品,專利價值在不斷交易中逐漸顯現,得到相應的資金回報。美國生物醫藥生態系統較為完善,各環節都設置了機制政策和激勵措施,從而使得創新的果實能夠不斷接力成熟,這是生態系統的靈魂。
“全球基礎研究+美國專利+美國、法國諾獎+美國商業化”
全球基礎研究:1987—2011年,經過25年探索,由多國多名科學家共同完成CRISPR/Cas9系統基礎理論研究。在CRISPR/Cas9基因編輯技術相關的基礎理論研究方面,作出貢獻的基本沒有美國人(圖1)。第一個發現CRISPR序列的是日本科學家;之后,對探索和發現CRISPR/Cas9機理作出主要貢獻的大都是歐洲科學家。
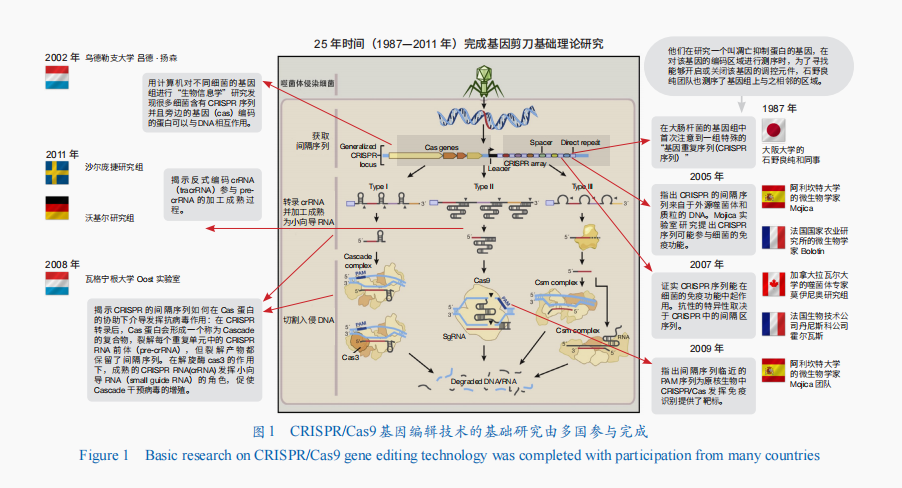
美國專利:2012年,來自瑞典于默奧大學的法國科學家埃瑪紐埃勒·沙爾龐捷(Emmanuelle Charpentier)和美國加利福尼亞大學伯克利分校的珍妮弗·杜德納(Jennifer A Doudna)共同揭示了Cas9蛋白的工作機理,隨后才意識到CRISPR/Cas9可以作為基因剪刀來使用,發表了文章并申請了相關專利。2013年,哈佛大學的喬治·丘奇(George Church)、麻省理工學院的張鋒和加利福尼亞大學齊磊(Lei S. Qi)實驗室,首次將CRISPR/Cas系統成功應用到哺乳動物細胞中,申請了相關專利。
美國、法國諾獎:沙爾龐捷和杜德納獲得2020年諾貝爾化學獎。
美國商業化:美國福泰制藥(Vertex Pharmaceuticals)和瑞士美國合資公司CRISPR Therapeutics聯合開發了利用CRISPR/Cas9基因編輯技術的基因療法Casgevy,分別于2023年12月和2024年1月經FDA批準用于治療鐮狀細胞病、輸血依賴性β地中海貧血癥(定價220萬美元)。Casgevy是FDA批準的第一個利用CRISPR/Cas9基因編輯技術的療法。
美國科學家擁有敏銳地將科學轉化為產品的意識和能力,輔以美國強大的生物醫藥創新生態,助力美國可以將全球的基礎研究投入轉化為本國的商業利益。如果沒有這種意識和能力,以及完善的生態,再多的基礎研究投入也只是為他人作嫁衣,這在歐洲(如青霉素、單克隆抗體)、日本(如PD-1單抗)和中國(如青蒿素)都有一定的教訓。
對生物醫藥產業從基礎研究到商業化過程的認識
若不重視創新制度框架和創新激勵,僅加大研發投入無法轉化為經濟社會產出
英國(如青霉素、單克隆抗體)和日本(如PD-1單抗)的實踐表明,科學論文或知識產權對社會的影響是有限的,關鍵是如何將想法轉化并運用到實踐中,產生經濟社會效益。文化是最根本、最持久,也是最難模仿的競爭力,建立創新文化極為重要,也極為艱難;但是,只有將創新制度、創新政策和創新文化有機結合起來,勁往一處使,才能真正打造出有效激勵顛覆性創新產生、成長的土壤、環境和生態系統。
歐洲基礎研究強,但科學向產業轉化的激勵不足
歐洲的政策解決方案往往側重于向基礎研究注入更多資金,以填補與美國的差距。資助基礎研究對于現代工業經濟至關重要,但除非歐洲的政策制定者也能解決其文化和政治體系中面臨的激勵問題,否則增加的投入不一定會產生預期的收益。前述案例中,青霉素、單克隆抗體的基礎研究都是由英國科學家完成的,但最后藥品開發和商業化都落在美國,這并非偶然事件。
將視野放大來看,據估算,2015—2021年,全球新生物技術公司中,歐洲僅占25%,只有1/3的新藥批準來自歐洲生物醫藥生態系統。原因在于:歐洲資本、知識、人才密集度與美國相比還較低。企業家、技術人才和投資者的大量聚集于硅谷和紐約,對美國初創企業的成功產生了重大影響;美國一半以上的初創企業是從這2個城市崛起的。盡管倫敦、巴黎、柏林和斯德哥爾摩在歐洲處于領先地位,但在資本、知識和人才集中度方面尚未達到同等水平;只有30%的歐洲初創公司將總部設在上述城市。對基礎研究和商業轉化的資助不平衡。歐洲對大學的純基礎研究有充足的支持,但對向商業化的過渡缺乏足夠的資金支持。缺乏創新創業的文化傳統。從思想認識和學術文化上,英國科學家更關注科學方面,而不是商業應用。里德·霍夫曼就一語道破,“硅谷不是一個地點,而是一種心態”。麥肯錫的一份研究報告分析了一些國家的媒體對創業的態度,德國對創業精神的積極描述比例僅為17%,而美國為39%。除了缺乏創業心態,還缺乏創業知識,敢于創業的人也就比較少,德國只有5%的人有創辦公司的計劃。
日本創新制1對1教學度框架不完善,政策一致性不夠
前述案例中,在21世紀初的日本,大學因缺乏申請專利的動力和能力,諾獎級成就只能依托發明人個人與產業界的聯系,專利才得以申請。專利申請沒有可靠的制度支撐,而是依靠偶然性獲得。此外,日本科學家即使申請到了專利,但是其國內的生物醫藥公司眼光和實力并不足以孵化顛覆性的技術產品,專利最終也難以在本國商業化。
將視野放大來看,盡管日本在基礎研究質量方面名列前茅,政府也有政策,但將學術知識轉化為商業或社會收益的系統存在缺陷。美國麻省理工學院的一篇論文指出,日本與美國相比,產業發展的利益相關者結構基本相同,但在活性、數量和質量上存在一些差異。 研發投入強度較高但規模仍偏小。2000—2019年,日本的研發強度連續20年高于美國,但與美國相比規模仍然相對較小。生物醫藥創新具有高投入的特征,投入量級至關重要。人才流動性低,知識、技術等信息在利益相關者之間共享困難。日本的薪資是按照終身雇傭資歷排名的,日本大學和工業界研究人員的流動性低,每個利益相關者的知識僅在自己的組織中積累,而不是在利益相關者之間共享。風險資本規模小且專業性不足。以2017年為例,風險資本總額,日本僅為美國的2%;風險投資占GDP的比重,美國為0.4%,日本為0.03%。美國每筆交易的風險資本在種子階段為170萬美元(日本為50萬美元),在早期階段(A輪融資階段)為1100萬美元(日本為80萬美元),在后期階段為2880萬美元(日本為100萬美元)。此外,生物醫藥領域的高風險性對風險投資家的專業性要求也高,美國風險投資家很多都擁有醫學博士(MD)和/或博士(Ph.D.)學位。而日本投資方明顯缺乏專業性,導致對創業者/初創企業的支持不足,這從前述PD-1案例可見一斑。 技術轉讓面臨挑戰。生態系統的核心價值是大學、初創企業和制藥公司之間的技術交換。從專利數量來看,東京大學和京都大學的國際專利數量超過了美國的哈佛大學和斯坦福大學。然而,日本大學的專利總收入相當低。哈佛大學和斯坦福大學的年收入始終保持在4000萬美元以上,而日本的大學從未超過1000萬美元。美國大型藥企強調開放式創新,大型藥企和初創生物技術公司與大學之間形成良好的合作生態;而日本大型藥企往往只注重內部研發,這極大地降低了日本生物醫藥產業的創新能效。⑤ 企業數量和活力均不足。日本生物醫藥產業集群中的企業數量遠少于美國,日本的創業態度低迷。大學的學生能接觸到創業者的機會非常有限。由于缺乏企業家榜樣,學生害怕成為企業家,導致日本的企業家人數較少。 支持性服務組織不成熟。企業家數量較少,意味著對企業家的支持和/或服務的需求較低。同時,日本企業家或初創公司的小團隊通常不具備建立公司所需的所有技能和知識,這形成了惡性循環。在美國,有許多支持性組織可以為初創企業特別是“加速器”“孵化器”提供服務,包括專門針對生物技術初創企業的項目;同時,美國還有在生物技術方面擁有豐富專業知識的律師事務所和顧問。日本嘗試移植這些系統,但才剛剛開始,這些活動的可用性還不夠。日本還面臨政策一致性的問題。面對人口老齡化的挑戰,日本進行了嚴格的藥品價格管制,1981—1991年的11年間,日本的藥品價格下降了67.9%。在整個專利保護期內,無論創新價值如何,日本的藥品價格都會定期統一調整。這導致了日本公司推出一系列產品壽命短、創新價值低的新藥,而不是投資于更實質性的創新。日本政府認識到其制藥行業步履蹣跚,在2010年推出了一項名為“價格維持溢價”(PMP)制度的試點計劃,旨在為創新者創造一個穩定可靠的定價環境。PMP于2012年、2014年和2016年更新。減少藥物審批滯后,確保日本創新產品得到了適當的估值,促進了創新。但是,2017年12月,日本厚生勞動省又實施了改革,大幅增加獲得PMP資格的難度;還于2018年降低了幾種主要創新藥物的價格,并且這些藥物需要接受持續的衛生技術評估(HTA)成本效益試點計劃,從而降低了上市時授予的價格溢價。日本政府反復橫跳,既想擁有一個創新的具有競爭力的生物醫藥產業,但又繼續人為壓低藥價,兩者始終難以兼顧,阻礙了其生物醫藥產業的發展。
完善的創新生態可吸收他國的基礎研究成果,進而轉化為本國收入
疾病是人類共有的,生物醫藥產業是全球化的,基礎研究是全球投入和全球的科學家共同努力的成果。美國擁有成熟的創新生態,除了自身的科研成果可以轉化為產出,其他國家的科研成果也可以在美國轉化。美國成熟的創新生態能將風險極大的事情,通過各種交流機制傳導,分散投資風險,讓創新的火種不斷傳遞——過程中要么不斷進化成熟,要么快速退出。上述案例中,雖然日本、英國在基礎研究上取得了突破,并因專利保護獲得了專利授權收入,但是商業化還是在美國才得以完成。以“藥王”修美樂為例,英國公司獲得了69億美元的收購費用,美國雅培公司則繼續投入后續臨床研發、適應證拓展、市場營銷、生產基地及物流,最終換來超過2000億美元的回報。日本的科學家及醫藥企業無法完成PD-1商業化,最后由美國百時美施貴寶公司接棒;藥品還未上市,該公司股價便上漲約130%(2013—2015年),從而支撐企業的進一步創新。CRISPR/Cas9基因編輯技術的基礎研究涉及多國科學家的貢獻,包括日本、加拿大、法國、瑞士等,但是最后關鍵性的技術發明和商業化主要是在美國完成。這些案例表明,若只重視基礎研究投入而忽視創新生態,容易陷入為他人作嫁衣的境地。
綜上,生物醫藥產業的競爭不僅是基礎研究的競爭,更多是整個創新生態體系后的體制機制的競爭。美國在生物醫藥領域處于全球領先地位,得益于其完善的創新體系,包括龐大的支持購買創新的國內市場、政府不限制藥品價格、知識產權保護、支持性的科學九宮格政策和支持性的創新集群等。這些反過來又鼓勵了大量的私人研發投資,形成了風險投資所需的充滿活力的生物醫藥創業生態系統,以及生物醫藥學術界、政府和工業界之間的協作環境。
相關建議
要把提高基礎研究投入與持續完善生物醫藥創新生態作為促進我國生物醫藥產業高質量發展的兩大方向,后者可能更為緊迫。
基礎研究的重要性仍需重視
雖然通過歐洲和日本的實踐看出,基礎研究并不是萬能神藥,但是仍然應該清醒地意識到,基礎研究薄弱是我國生物醫藥領域的重大短板。我國必須貢獻大量“0到1”的成果,以得到世界科學界的尊重認可。以2021年為例,我國政府在所有自然科學領域基礎研究的投入為1679億元人民幣,僅相當于美國NIH在2022年對生物醫學領域基礎研究的投入。我國在生命科學領域基礎研究的投入還需大力增加,才能奠定科學基礎。由于我國自身根源上缺乏基礎上的創新,大多創新藥科學家為留學海外并曾在跨國藥企工作多年的人員,導致過多同靶點的仿首創新(Fast Follow),致使外國同行誤解,認為中國學者有剽竊專利之嫌,影響中國創新的聲譽,面臨諸多風險。
完善生物醫藥從基礎研究到商業化的創新生態
我國高校院所對生物醫藥基礎研究的貢獻還非常不足。如前述,我國初創生物技術公司很多是留學歸國人員,本土大學對科學、技術、人才的供給還非常不足,尚未形成氣候。這是我國生物醫藥產業創新生態的重要缺陷,應做出相關改革。設置類似美國NIH這樣,專門、專業化資助生物醫學研究的渠道和機制,在統一的資助渠道下,內設對初創企業資金支持的機制,推動研究成果轉化。目前,我國對生物醫學研發的資助分散在不同部委,缺乏統一規劃和資助機制。科研1對1教學經費由政府部門一手操辦,而不是由獨立的學術機構承辦;由于生物醫學學科廣泛,通常只有數名項目人員組織項目立項、評審,不盡合理,既難以適應科技創新規律又增加決策風險。提高生物學相關課程質量。伴隨知識的飛速擴張,現在的教學體系中,教師經常注重深入講解某一小領域的最新知識,但這種碎片化的知識,缺少整體性,不容易看到不同現象后的共同本質,不容易在新的問題面前運用已經學過的知識。對于培養具有寬闊視野和深入洞察力的思想家和科學家是遠遠不夠的。建議選擇一些高質量的教材開設高質量的科學史課程,還原科學知識產生的真實過程,其中飽含曲折艱難。這一方面可以激勵科學研究人員,另一方面可以摒除迷信科學的思想和做法;科學的靈魂從不是崇拜而是批判,用科學精神來指導研究工作,提升創造能力和融合能力。例如,饒毅開發的《生物學概念與途徑》課程可通過遠程教育的方式廣泛傳播。普遍增加生物醫學領域MBA等創新創業教育課程的供給,增加在校學生接觸創業者的機會,暢通企業家和大學教師之間的職業交流通道。通過接觸企業家榜樣,激發學生的創新創業激情。即便不去創業,學生也能夠了解企業、市場的需求。暢通醫療機構和生物技術公司的常態化交個人空間流合作通道。發揮我國豐富的臨床研究問題導向優勢,形成臨床需求和產品研發的良性循環,避免企業研發立項主要依靠“看市場上哪個藥賣得好”而導致的盲目跟風式惡性循環。暢通高校院所、醫院等財政支持項目的科技成果轉化通道,徹底解決“不敢轉”的難題。我國大多數科研人員都在國有的高校院所、醫院工作。要妥善處理職務發明成果轉化收益獎勵與國有資產管理的關系,充分調動體制內科研人員發明創造的積極性,推動科技創新帶動產業創新。不斷提高我國醫藥監管的水平,完善藥品知識產權保護體系。藥品監管和知識產權保護是支持生物醫藥產業創新發展的重要基石制度,需要高度重視,花費更大力氣去完善。
購買端是生物醫藥產業創新生態的重要部分,要充分激活我國超大規模市場購買創新的潛力
美國的生命科學創新部門由大型成熟藥企和小型初創生物技術公司組成,大型成熟藥企創造了“對新技術的需求”,從而小樹屋能夠激勵小型初創生物技術公司的發展。美國小型初創生物技術公司的成立受到NIH的“小企業創新研究計劃”(STTR)、“小企業技術轉移計劃”(SBIR),以及大量風險資本的支持而創辦,退出渠道通常是大型藥企的并購或者首次公開募股(IPO)上市。進一步的研究發現,23%的生命健康類初創企業的退出通過IPO,48%通過并購退出的,29%退出失敗。其中,通過并購退出的可能最終也是失敗的,這個風險由收購方承擔。一般較為成熟的融資市場,IPO收緊會導致并購市場的火熱,一些生物技術公司可以選擇被并購的方式進行退出。美國生物技術公司從20世紀80年代開始發展,但從生物技術公司成功晉級大型藥企的僅5家,分別是安進、吉利德、渤健、再生元、福泰制藥——全部依靠超級大單品實現“蝶變”。從成立到首款產品獲批上市平均10年以上,實現穩定盈利甚至需要20年以上,在此期間需要源源不斷的資本活水來維持高額的研發投入。據“阿基米德Biotech”研究,我國2家出海最成功的創新藥企——百濟神州和和黃醫藥商業化收益全靠海外支撐;由于受到價格談判影響,國內市場收入有停止爬坡的跡象,這與生命周期早期成長階段不匹配。
我國至今尚無國際私密空間化的大型藥企,傳統藥企大都是原料藥企、仿制藥企,利潤較低。因此,我國生物技術初創公司缺乏像美國那樣既有資金實力又具有專業眼光的購買方(大型藥企),幾乎只能依賴IPO;一旦IPO中斷,那么整個產業的發展便失去了激勵。同時初創公司的風險是極大的,太高的風險也是股市、股民難以承受的。當前,我國一些初創公司海外授權一些優質管線僅是權宜之計。長遠來看,必須發展我國的具有國際競爭能力的大型藥企,為我國初創生物技術公司成功晉級大型藥企提供優渥環境極為重要。若不積極改善,我國的“種子”只能在國外開花結果,或者在國內銷聲匿跡。
我國初創生物技術公司當前面臨的主要問題是融資難、定價低和進醫院銷售難。2024年風險投資投向創新藥的資金比2021年下降70%,絕大部分企業融不到資金;企業“賣青苗”給跨國公司,也是“融資難”大背景下的現實選擇。融資難的原因是定價太低。醫保靈魂砍價結果是,中國創新藥價格平均比全球最低價低39%,比美國低90%,比歐洲和日本低50%—70%。全國三級醫院1.2萬家、三甲醫院3300家,只有5%—10%的醫院采購創新藥達到上市數量的平均數。應下定決心迅速改變這種不利狀況。要高度重視購買端對生物醫藥產業的重要作用。只有這樣才能為我國培育出世界級的醫藥巨頭,豐富初創生物技術公司的退出渠道,形成可持續的生物醫藥創新系統,增強我國生物醫藥產業的全球競爭力。
(作者:馬曉玲,中國國際經濟交流中心。《中國科學院院刊》供稿)
